Im Zentrum dieser Umstellung stehen die Datenbanken der Food and Drug Administration (FDA) namens GUDID (Global Unique Device Identification Database) und diejenige der EU namens EUDAMED (European Database on Medical Devices). Beide verlangen eine einmalige Produktidentifikation, welche über das UDI-System (Unique Device Identification) gehandhabt wird. Alle Medizinprodukte müssen mit dieser einmaligen UDI-Produktidentifikation gekennzeichnet und auf die entsprechende Datenbank übertragen werden.
Die Erfassung der Medizinprodukte bzw. das Übertragen der Daten der Medizinprodukte auf die Datenbanken verläuft schrittweise basieren auf ihrer Risikoklasse und befindet sich bei der FDA in der letzten Phase. Nach erfolgreichem Abschluss der Klasse 3, 2a und 2b Produkten, kommt es jetzt zur finalen Phase. Diese besteht aus den Medizinprodukten der Klasse 1 sowie allen nicht klassifizierten Medizinprodukten, welche bis am 24.09.2020 zur GUDID übertragen werden müssen.
Im Gegensatz zur FDA hinkt die EU mit der Einführung von UDI etwas hinterher. Die Gesetzgebung, auf der die Erfassung der Medizinprodukte aufgebaut ist, hat mehr Arbeit verursacht als geplant. Dementsprechend wurde diese später als vorgesehen veröffentlicht. Zudem wurde jetzt auch noch der Start der Anwendung eben dieser Medizinprodukte-Verordnung (MDR 2017/745, engl. Medical Device Regulation) aufgrund der Corona-Krise um ein Jahr auf den 26.05.2021 verschoben.
Das Europäische Parlament nahm den Vorschlag der Kommission am 17.04.2020 an. Nach der Billigung durch die Mitgliederstaaten wurde am 23.04.2020 die Änderung im Amtsblatt (hier zum Nachlesen) publik und damit rechtskräftig gemacht. Der geplante Start der Anwendung der Verordnung über In-vitro-Diagnostika-Medizinprodukte (IVDR 2017/746), welcher auf den 26.05.2022 geplant ist, ist nicht betroffen von einer Verschiebung betroffen und soll wie geplant stattfinden.
Obwohl die Voraussetzungen, wie zum Beispiel die Fertigstellung der EUDAMED, noch nicht alle gegeben sind, müssen sich Unternehmen zeitnah vorbereiten. Die Umstellungen aus der MDR bzw. die Einführung von UDI hat weitreichende Folgen. Betroffen sind unter anderem die Klassifizierung, die technische Dokumentation, die klinischen Daten und das Qualitätsmanagementsystem.
Besonderheit der UDI Datenstruktur der EU
Das UDI Modul der EU wird teils gleiche oder ähnliche UDI Attribute, wie auch neue detailreichere Informationen enthalten wie die vergleichbare Datenbank (GUDID) der amerikanischen Gesundheitsbehörde (FDA).
Der Hauptunterschied zur GUDID besteht darin, dass sich die UDI Daten in den Bereich BASIC UDI-DI und die UDI-DI aufteilen. Die BASIC UDI-DI dient dazu, alle gemeinsamen Eigenschaften einer Produktgruppe abzubilden. Die UDI-DI enthält nur die produktspezifischen Informationen. Zu einem BASIC UDI-DI kann es mehrere UDI-DIs geben. Umgekehrt ist eine UDI-DI genau einem BASIC UDI-DI zugeordnet (Abbildung 1).
Als Wirtschaftsakteur ist man selbst dafür verantwortlich alle UDI Attribute im eigenen Unternehmen zu verwalten und die Daten zur EUDAMED zu übertragen.
UDI Datenübertragung zur GUDID und EUDAMED
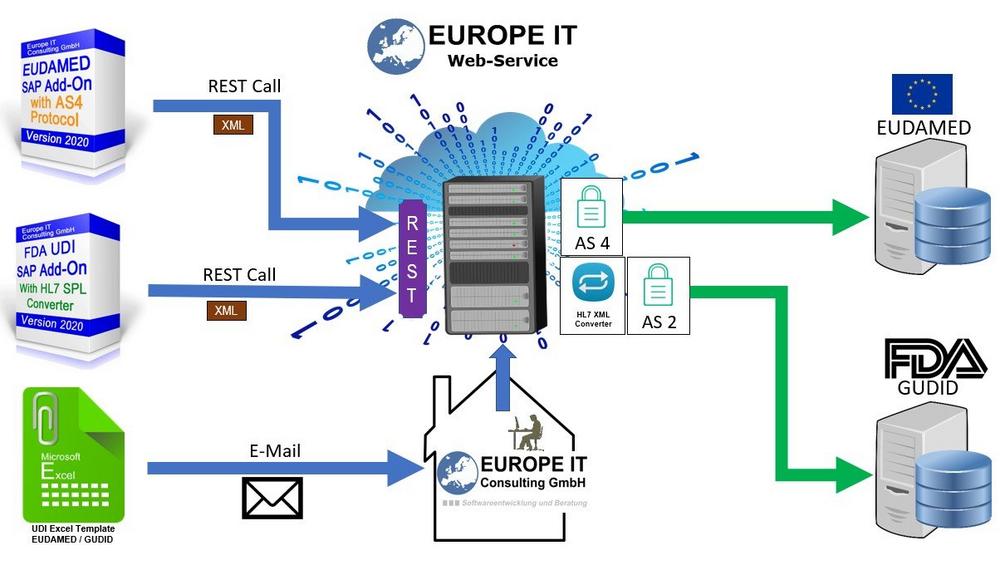
Eine der Herausforderungen bei der Umsetzung der Anforderungen der FDA bzw. der Europäischen Kommission ist es die UDI Daten im richtigen Format zu den Behörden zu übertragen. Als Technologie-Unternehmen bietet die Europe IT Consulting GmbH einen Dienstleistungsservice an, bei dem die UDI Daten in das passende Format transformiert und anschliessend an die Behörden übertragen werden.
Welche Möglichkeiten habe ich als Kunde:
1. UDI Daten als Exceldatei zusenden
Sie haben die Möglichkeit, uns ihre UDI Daten in einer Exceldatei zu senden. Dafür liefern wir Ihnen zuvor ein Excel-Template aus, in dem Sie Ihre Daten pflegen. Wir transformieren die Daten in das passende Format und führen den Upload auf die Datenbank für Sie durch. Für die Übermittlung der Daten auf die GUDID werden die Daten in das geforderte HL7 SPL XML Format transformiert.
2. Datenübertragung mit XML Dateien aus SAP heraus
Sie nutzen bereits unser UDI SAP Add-On zur Verwaltung Ihrer Medizinproduktestammdaten? Dann können Sie entweder mit dem Datenexport Report die Daten auf Ihren lokalen PC exportieren und uns die XML Dateien zumailen oder direkt auf unseren Cloud Server ablegen.
Wir konvertieren die XML Dateien in das HL7 SPL XML Format vor der Übertragung der Daten zur GUDID.
3. Datenübertragung mit dem UDI SAP Add-On direkt aus SAP heraus
Wenn Sie bereits unser UDI SAP Add-On zur Verwaltung Ihrer Medizinproduktestammdaten nutzen können Sie direkt aus ihrem ERP System heraus den Datenexport und gleichzeitigen Upload zu unserem Cloud Server nutzen.
Durch einen RESTFull WebService bekommen Sie direkt die Bestätigung über den erfolgreichen Upload auf unseren Cloud Server.
Das UDI Add-On fragt dann den Status der Datenübertragung und den Status auf der Behördendatenbank automatisch im Hintergrund ab, so dass Sie immer auf dem neuesten Stand sind (Abbildung 2).
Weitere spannende und hilfreiche Informationen rund um das Thema UDI, EUDAMED und GUDID finden Sie auf unserer Webseite www.europe-it-consulting.ch.
Europe IT Consulting GmbH
Steinentorstrasse 35
CH4051 Basel
Telefon: +41 (61) 508 73 34
http://europe-it-consulting.ch
Business Consultant
Telefon: +41 (61) 508 73 34
E-Mail: p.meyer@europe-it-consulting.ch
![]()